En choisissant la physique-chimie comme spécialité en Première, tu as fait le choix de rencontrer le tableau d’avancement. Pour le meilleur ou pour le pire, on ne saurait le dire ! On aimerait que ça se passe bien alors, on te présente en détail tout ce qu’il y a à savoir. C’est parti ! 🚀
Qu’est-ce que le tableau d’avancement ? 🤔
👉 Le tableau d’avancement permet de décrire l’évolution des quantités de matières des réactifs et des produits d’une réaction chimique. Ça se fait durant la réaction en passant d’un état initial à l’état final en fonction de l’avancement x.
💡 Pour info
L’avancement, que l’on écrit x s’exprime en mole. Il correspond à la quantité de matière qui a réagi au moment de la réaction. Le tableau d’avancement est un élément incontournable lorsque tu fais de la chimie. Il sert à :
👉 Identifier facilement le réactif limitant
👉 Prévoir les quantités de matières à la fin de la réaction
👉 Faire le bilan des quantités de matières lors d’une transformation chimique.
À lire aussi
✅ Pour comprendre le tableau de Mendeleïev, c’est par ici !
Dans quel contexte utiliser le tableau d’avancement ? 🤔
Pour t’aider à comprendre comment ça marche, voici un petit exemple : lorsque le dioxygène et le monoxyde d’azote se rencontrent et réagissent ensemble rapidement, on constate la création de produits. Cette réaction crée de l’eau des acides nitreux et nitriques, qui engendrent les pluies acides.
👉 Grâce à l’avancement, on sait quelle est la quantité de matière présente dans les réactifs ainsi que dans les produits à n’importe quel moment de la réaction chimique.
💡 Pour info
Tu peux retenir que l’avancement est un chiffre qui est toujours positif.
Il ne peut pas être négatif. Si à l’issue, tu obtiens un avancement négatif, c’est que tu t’es trompé dans le calcul.

Ton premier cours particulier est offert ! 🎁
Nos profs sont passés par les meilleures écoles et universités.
Les essentiels pour réaliser le tableau d’avancement ✨
On a mentionné plein de termes qui peuvent être flous pour toi. Ils figurent tous dans le tableau d’avancement donc on va prendre le temps de les définir pour que ce soit plus clair pour la suite.
👉 Les réactifs : Les réactifs sont les substances qui sont présentes au début de la réaction et qui disparaissent au cours de celle-ci.
👉 Les produits : Ce sont les substances qui sont présentes à la fin de la réaction et qui apparaissent au cours de celle-ci.
👉 Le réactif limitant : Il s’agit de l’élément qui, transformé au cours de la réaction, disparaît complètement. Par conséquent, il est celui qui va arrêter la réaction chimique.
👉 Les coefficients stœchiométriques : dans une équation chimique, ce sont les chiffres ou les nombres qui indiquent dans quelles proportions les éléments qui composent la réaction sont présents. En gros, c’est la quantité des éléments.
⚠️ Important
👉 Avant de réaliser un tableau d’avancement, il est important de savoir réaliser une équation chimique. Alors entraîne-toi !

À lire aussi
✅ Découvre notre guide pour réussir l’épreuve de spécialité Physique-Chimie !
Comment remplir un tableau d’avancement ? 🤔
On passe maintenant aux choses sérieuses. Voici comment remplir ton tableau d’avancement !
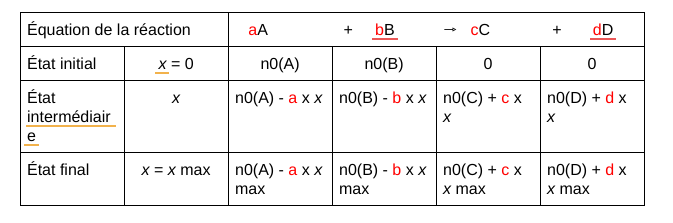
👉 1ʳᵉ phase : Durant cette étape, tu t’occupes de remplir la première ligne. Tu y places l’équation chimique qui est en jeu. Veille bien à équilibrer l’équation avant (à l’aide des coefficients stœchiométriques). Dans la plupart des cas, tu mets en jeu deux réactifs qui donneront deux produits.
👉 2ᵉ phase : Tu remplis la deuxième ligne. Tu y inscris le nombre de mol présent à l’état initial de chaque espèce chimique (le nombre de mol t’est donné dans la consigne de l’exercice en général. Tu as juste à retranscrire les chiffres).
👉 3ᵉ phase : Tu remplis la troisième ligne. Dans celle-ci, tu indiques le nombre de mol présent à un instant t de la réaction chimique. On l’appelle l’état intermédiaire. À l’état intermédiaire, tu écris : le nombre de mol à l’état initial, moins le chiffre stœchiométrique de l’espèce fois l’avancement x.
On va te présenter sous forme de formule, ça sera beaucoup plus clair ne t’inquiètes pas ! 😉
Pour la partie produit, tu ne mettras pas le signe – mais le signe +. En effet, il y a plus une diminution des espèces mais une création de celles-ci.
👉 4ᵉ phase : Enfin, durant la dernière étape, tu remplis la dernière ligne qui correspond à l’état final. Tu fais exactement la même chose que précédemment, sauf que cette fois-ci, tu remplaces l’avancement x par xmax. Donc, tu obtiens le nombre de mol à l’état initial, moins le chiffre stœchiométrique de l’espèce fois xmax.
💡 Focus vocabulaire
👉 L’état initial : Il définit le moment où l’on met en contact les réactifs.
👉 L’état intermédiaire : C’est le moment où la réaction chimique contient à la fois des réactifs ainsi que des produits. C’est à ce moment que les réactifs sont en train de se transformer en produits.
👉 L’état final : La réaction chimique est terminée. Par conséquent, elle n’évolue plus, il ne reste plus que les produits.

Besoin d’un prof particulier ? ✨
Nos profs sont là pour t’aider à progresser !
Exercice 📝
Dans cet exercice, on va te montrer comment déterminer l’état final d’une réaction chimique. Grâce à ça, on sera amené à trouver xmax ainsi que le réactif limitant.
Voici la réaction chimique que l’on va utiliser comme exemple (en rouge, les coefficients stoechiométriques) :
CH4 + 2 O2 → CO2 + 2 H2O
avec :
n(CH4) = 3 mol
n(O2) = 5 mol
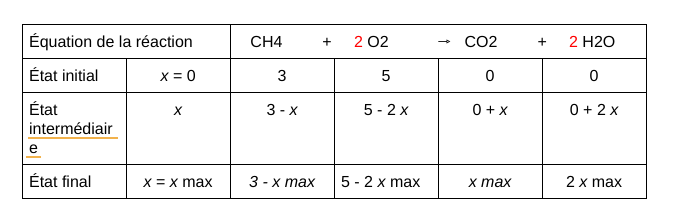
Pour déterminer le bilan de matière à l’état final, il va falloir trouver la valeur de x max. Pour ça, on va déterminer quel est le réactif limitant. Pour le trouver, on doit réaliser deux hypothèses :
👉 1ʳᵉ hypothèse, est que le réactif limitant est CH4.
👉 2ᵉ hypothèse, est que le réactif limitant est O2.
1ʳᵉ hypothèse :
On a 3 – x max = 0
Donc : x max = 3 mol
2ᵉ hypothèse :
On a 5 – 2 x max = 0
Donc : 5 = 2 x max
5 / 2 = x max.
Donc x max = 2,5 mol.
Le réactif limitant est celui qui possède l’avancement maximal le plus petit.
👉 Le réactif limitant de cette réaction est O2.
👉 x max est 2,5 mol.
💪 Tu sais maintenant comment utiliser un tableau d’avancement et trouver l’état final d’une réaction chimique.
💡 Pour info
Il se peut que parfois, on ne te donne pas la quantité de mol des éléments présents dans la réaction chimique. Si tu te trouves dans cette situation, tu peux utiliser la formule n = m / M
👉 Elle te permet de trouver le nombre de mol en fonction de la masse et de la masse molaire de l’élément. Donc apprends-la par cœur ! ❤️
Besoin de cours particuliers ? ✨
4 points de plus sur ta moyenne avec nos profs Sherpas ! 📈
Comment progresser en physique-chimie ? ✨
👉 Fais des fiches : les fiches de révision, c’est l’idéal pour progresser. Ça te permet d’apprendre tes formules et c’est hyper pratique pour réviser. Si jamais tu as des difficultés pour réaliser une fiche de révision, on a ce qu’il te faut !
👉 Réalise des exercices : pour progresser il n’y a rien de mieux que de s’exercer ! C’est pourquoi, on t’encourage à sortir une feuille de papier et un stylo et de t’y coller régulièrement.
👉 Demande de l’aide à l’un de nos Sherpas : Si malgré tous ces petits conseils tu continues d’avoir du mal en physique-chimie, fais appel à l’un de nos Sherpas. Rends-toi sur Sherpas.com, tu y trouveras forcément la perle rare !

Cette fiche sur le tableau d’avancement est maintenant terminée, on espère qu’elle t’a été utile ! N’hésite pas à nous laisser un petit commentaire. 😉