Le tableau de Mendeleïev, tu l’as déjà remarqué quand tu regardais Breaking Bad 😜. C’est d’ailleurs cette série qui t’a donné envie de devenir chimiste… Non pas pour faire comme Walter White, mais parce que les potions et les atomes, c’est ton domaine ! Pour faire ce métier, tu as besoin de comprendre le tableau de Mendeleïev (légende de la chimie).🔬
Et pour réussir en chimie rien de mieux que des cours de soutien scolaire spécialisés en chimie avec nos Sherpas dédiés. Lance-toi dans cette aventure scientifique maintenant ! 🚀
Qu’est-ce que le tableau périodique des éléments ? 🤔
Le tableau périodique de Mendeleïev 🔬
Le tableau périodique des éléments représente tous les éléments chimiques qui ont été découverts par l’homme. Il a été créé en 1869 par le chimiste russe Dmitri Mendeleïev. Il est depuis devenu un référentiel universel et contient aujourd’hui 118 éléments (à l’origine, il n’y en avait que 63 !). Le premier étant l’hydrogène et le dernier l’oganesson. On t’explique pourquoi ils sont dans cet ordre après. 😉
Qui est Dmitri Mendeleïev ? 🧐
Dmitri Mendeleïev est un chimiste russe né en 1834. 🇷🇺 Après avoir publié son tableau périodique des éléments, Mendeleïev ne s’est pas arrêté. Il s’est par la suite intéressé à l’origine du pétrole et son optimisation.
Enfin, il a contribué à unifier toutes les unités de mesures qui étaient présentes jusqu’alors en Russie. Après avoir bien œuvré tout au long de sa vie, il meurt en 1907 à Saint-Petersbourg.

💖 Fun Fact
Selon la légende, Mendeleïev serait l’inventeur de la vodka. Il aurait déterminé le degré d’alcool nécessaire à cette boisson. Il l’aurait fixé à 38 degrés. Le degré d’alcool a par la suite été augmenté pour faciliter le calcul des taxes sur l’alcool. 😏
👉 Par exemple, l’Absolut Vodka a un degré d’alcool de 40°.
La construction du tableau de Mendeleïev ⚒️
La composition du tableau 🧐
Le tableau périodique des éléments, comme son nom l’indique, est composé d’éléments. 😅 Il en contient précisément 118. Tous les éléments présents dans le tableau sont présentés dans une case qui contient des chiffres et des lettres (ne pense pas au jeu télévisé 😉). Voici ce que représentent les chiffres et les lettres :
- Le numéro atomique : la plupart du temps, il se situe en haut à gauche.
- La masse atomique : qui se situe en haut du côté opposé au numéro atomique.
- Le symbole chimique de l’élément : il est situé au centre de la case
- Le nom de l’élément : en bas de chaque case est situé le nom de l’élément en entier.
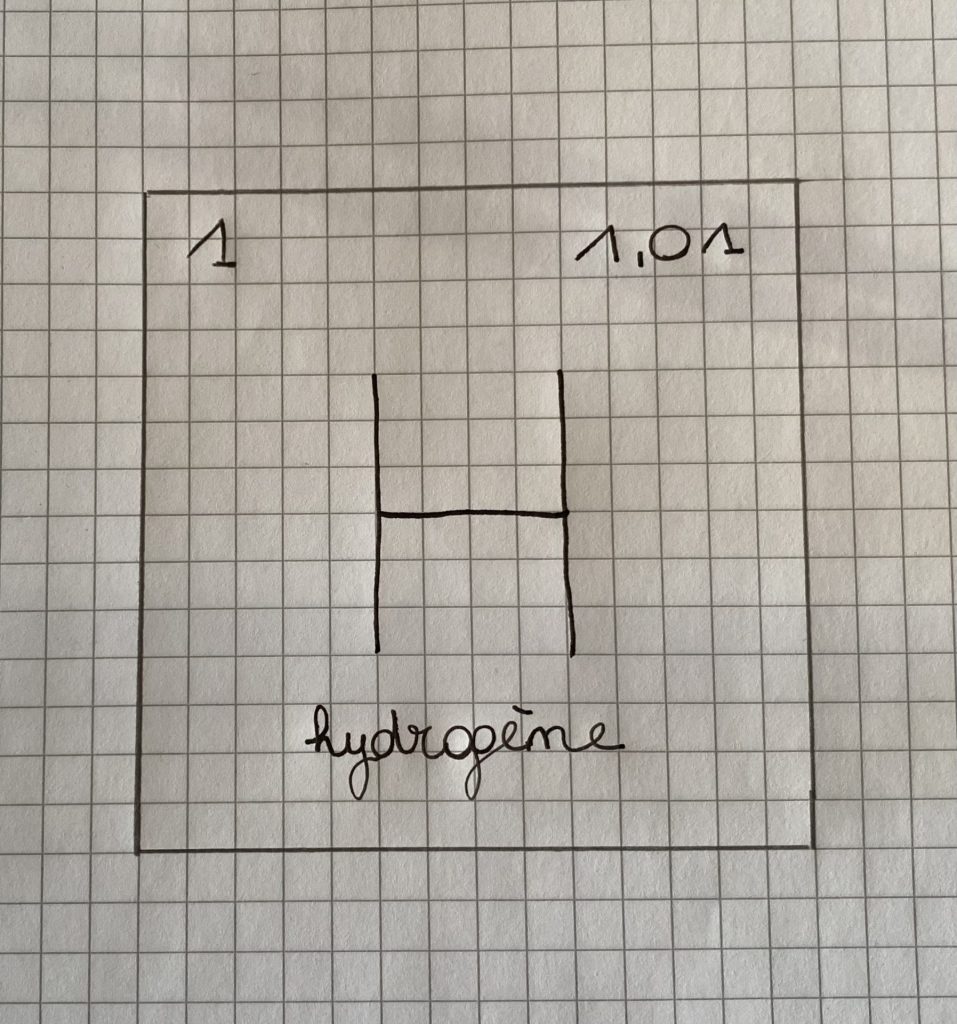
Prenons exemple sur l’hydrogène :
- Le 1, représente son numéro atomique.
- 1,01 représente sa masse atomique
- Le H représente son symbole chimique.
- Hydrogène, en bas, représente le nom de l’élément.
Définition des composants de chaque élément 🧐
On vient juste de te donner des termes chimiques et pour ne pas te laisser dans l’ignorance, voici leur définition.
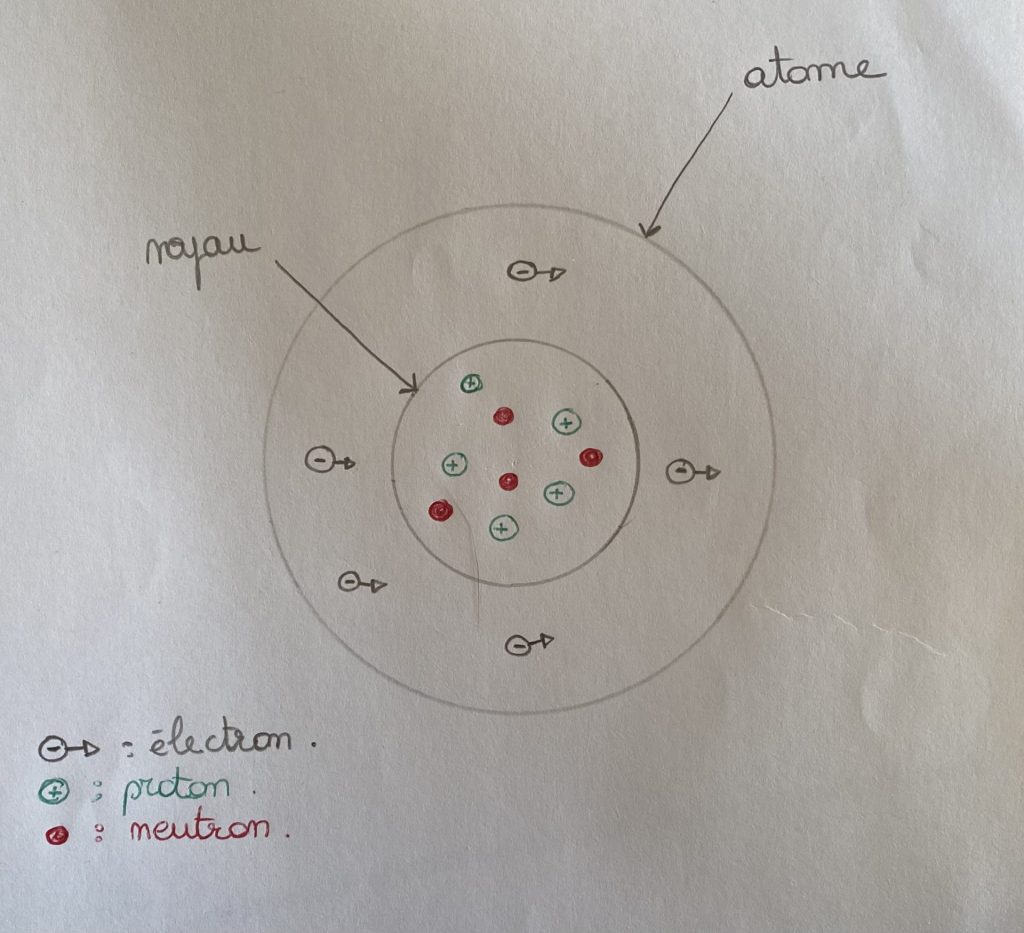
👉 Le numéro atomique : également écrit Z, représente en physique et en chimie, le nombre de protons (d’une charge électrique positive) dans un atome.
💡 Pour info
Dans un atome, il y a autant de protons que d’électrons. Pour que l’atome soit stable, il faut autant de protons (charge positive) que d’électrons (charge négative).
👉 La masse atomique : la masse atomique d’un élément chimique représente la somme de protons et de neutrons présents dans son noyau. Elle est souvent assimilée au nombre de masse. Pour la calculer, il suffit de faire la somme des protons et des neutrons.
💡 Rappel
Même si tu as déjà de bonnes connaissances en physique-chimie, voici un petit rappel. On trouve dans un atome trois éléments :
- le neutron
- le proton
- l’électron.
Les neutrons et les protons sont dans le noyau de l’atome et sont chargés positivement (ensemble, les neutrons et les protons forment ce qu’on appelle les nucléons). À l’extérieur du noyau, tu trouves les électrons qui sont chargés négativement.
👉 Le symbole chimique de l’élément : dans la plupart des cas, le symbole chimique ressemble au nom de l’élément. Exemple : le symbole du Fer est Fe. Cependant, tu constateras que dans certains cas, il n’a absolument rien à voir avec celui-ci. C’est le cas du potassium, dont le symbole est K. Si tu te demandes pourquoi le K, sache que, nous aussi, on aimerait bien savoir. 😶

L’ordre des éléments dans le tableau périodique 🔢
Comme tu l’imagines peut-être déjà, la classification des éléments dans le tableau ne s’est pas faite au hasard ou par tirage au sort. La classification s’est faite selon les critères qu’on t’explique tout de suite.
💖 Fun Fact
Lorsque Mendeleïev a conçu son tableau, il avait anticipé que certains éléments n’étaient pas encore trouvés. De ce fait, il a pris la liberté de laisser des espaces (vides) pour permettre aux futurs chimistes de les placer dans le tableau.
Ça s’est révélé utile car plusieurs années après, des chimistes suisses ont découvert de nouveaux atomes. Ils ont ainsi pu les placer dans le tableau aux endroits que Mendeleïev avait laissés vide. Ce mec est un visionnaire. 🤩
👉 Le 1er critère de positionnement dans le tableau périodique est le numéro atomique par ordre croissant. Le premier élément est l’Hydrogène (il possède 1 comme numéro atomique), le second est l’hélium (il a comme numéro atomique le 2), jusqu’à arriver à l’oganesson, dont le numéro atomique est 118.
👉 Il se peut que certains éléments aient le même numéro atomique (on appelle ça des isotopes). Dans ce cas, ils seront placés en fonction de leur configuration électronique. C’est-à-dire, que leur ordre dans le tableau est en fonction du nombre d’électrons situés dans la couche externe de l’atome. Il s’agit donc du 2ème critère de placement des éléments dans le tableau.
💡 Pour rappel
-
- Des isotopes sont des atomes qui possèdent le même numéro atomique mais qui n’ont pas le même nombre de neutrons. Exemple avec le carbone, il peut posséder dans certains cas 13 ou 14 neutrons.
-
- Le nuage électronique d’un atome est constitué par un ensemble de couches d’électrons. La première couche appelée K peut contenir au maximum 2 électrons. La seconde couche, appelée L, peut contenir au maximum 8 électrons. Enfin, la troisième couche appelée M peut contenir jusqu’à 18 électrons maximum. Un atome peut avoir au total 6 couches d’électrons.
Comment lire le tableau de Mendeleïev ? 🤔
À l’horizontale ▶️
La première manière de lire le tableau de Mendeleïev est à l’horizontale. Le tableau compte au total 7 lignes que l’on peut aussi appeler des périodes (d’où le nom du tableau). À l’horizontale, les éléments sont placés en fonction de leur numéro atomique et par ordre croissant.
À la verticale 🔽
Tu peux dans un second temps, lire le tableau de Mendeleïev à la verticale. Le tableau contient au total 18 colonnes. Ces colonnes sont également appelées ‘familles’ car elles regroupent des éléments qui ont des propriétés similaires. Lorsque des éléments sont placés dans la même colonne, c’est qu’ils possèdent le même nombre d’électrons dans leur couche externe.
De nos jours, comment utiliser le tableau de Mendeleïev ?
Dans la vie de tous les jours, le tableau de Mendeleïev risque de ne pas t’être très utile. 😅 Si tu fais de la physique-chimie ton occupation principale, il te sera essentiel. Mais avant d’en arriver là, tu t’en serviras indubitablement en classe au collège et au lycée ! Voici quelques conseils pour l’utiliser.
👉 Ne l’apprend pas par cœur : on va tout de suite t’éviter du stress, ça ne sert à rien d’apprendre le tableau périodique par cœur. Le tableau te sera toujours fourni (ou une version plus réduite) en classe.
👉 Prends des notes : s’il n’est pas nécessaire de connaître le tableau par cœur, il est en revanche important de savoir ce que signifient les chiffres présents dans chaque case. N’hésite pas à te faire une petite fiche de révision !

Le tableau de Mendeleïev n’a maintenant plus aucun secret pour toi. On espère que cet article a pu t’aider dans sa compréhension et qu’il te sera utile. N’hésite pas à nous laisser un commentaire ! 😉
Approfondis ta compréhension du tableau périodique avec nos professeurs particuliers experts de chimie en ligne et maîtrise l’univers des éléments comme jamais auparavant. 🔬













Enfin une explication claire.Très bonne synthèse
Merci beaucoup pour votre commentaire ! 🥰
À très vite,