Lors de notre précédent article sur le tableau périodique des éléments, on t’a très rapidement parlé des isotopes. Le temps est venu de te faire une fiche spécifique sur le sujet pour que tu puisses le maîtriser pleinement. Ainsi, tu vas pouvoir te rendre compte que l’isotope, en plus d’être étudié à l’école, est aussi très utile dans la vie de tous les jours. C’est parti ! 🚀
Rappel sur l’écriture d’un élément chimique 💡
Pour repérer un isotope, il est important de bien connaître l’écriture d’un élément chimique, et de comprendre ce que représentent les chiffres et lettres qui y sont inscrits.
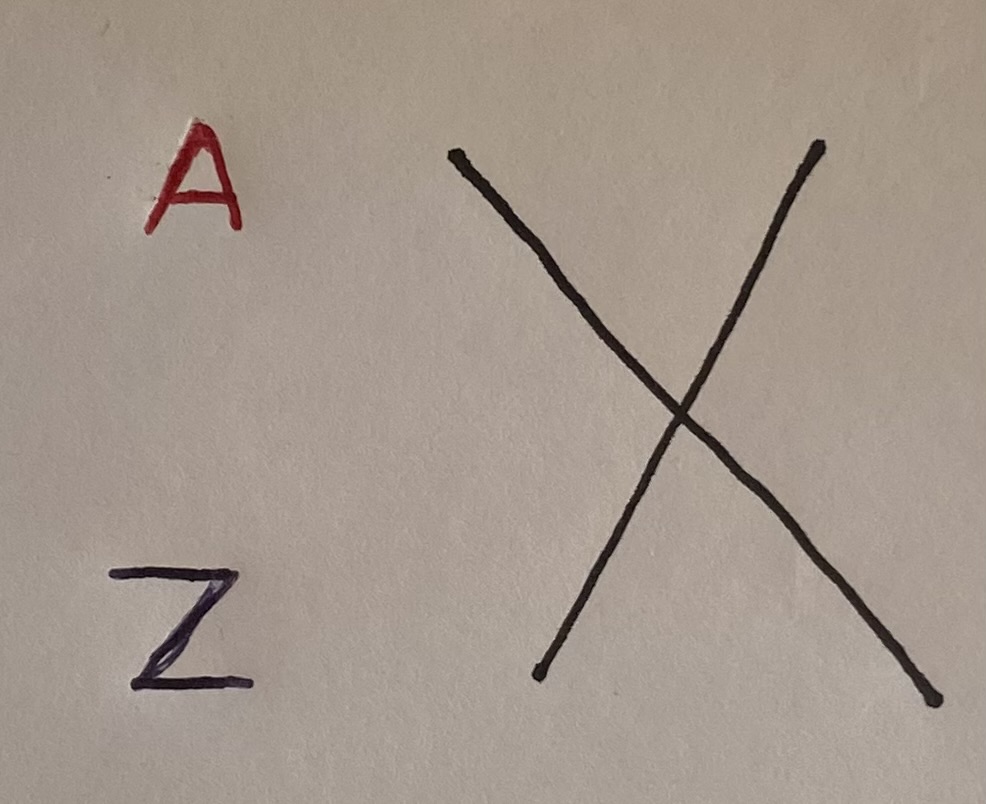
- La grosse lettre au centre, ici représentée par le X, est toujours le symbole de l’élément chimique dont il est question.
- La lettre Z, située en bas à gauche, représente le numéro atomique de l’atome. Ce numéro atomique représente les protons présents dans le noyau.
- La lettre A, située en haut à gauche, représente le nombre de nucléons que contient l’atome.
Rappel ✨
Le noyau d’un atome est composé de protons, qui sont chargés positivement et de neutrons. On appelle cet ensemble les nucléons. 😯
Pour qu’un atome soit stable, il faut qu’il y ait le même nombre de protons que d’électrons, qui eux sont chargés négativement. Ainsi, les forces se compensent et l’atome est considéré comme stable électriquement.
Si tu as encore des difficultés avec l’écriture des éléments chimiques, n’hésite pas à prendre un cours en ligne de physique-chimie avec l’un de nos Sherpas. Il saura t’aider !
Ton premier cours particulier est offert ! 🎁
Nos profs sont passés par les meilleures écoles et universités.
Qu’est-ce que les isotopes ? 🤔
Définition d’un isotope ✨
Les isotopes sont des atomes qui ont le même numéro atomique Z, soit le même nombre de protons. Mais, un nombre de nucléons A différent.
👉 Voici un exemple d’isotopes :
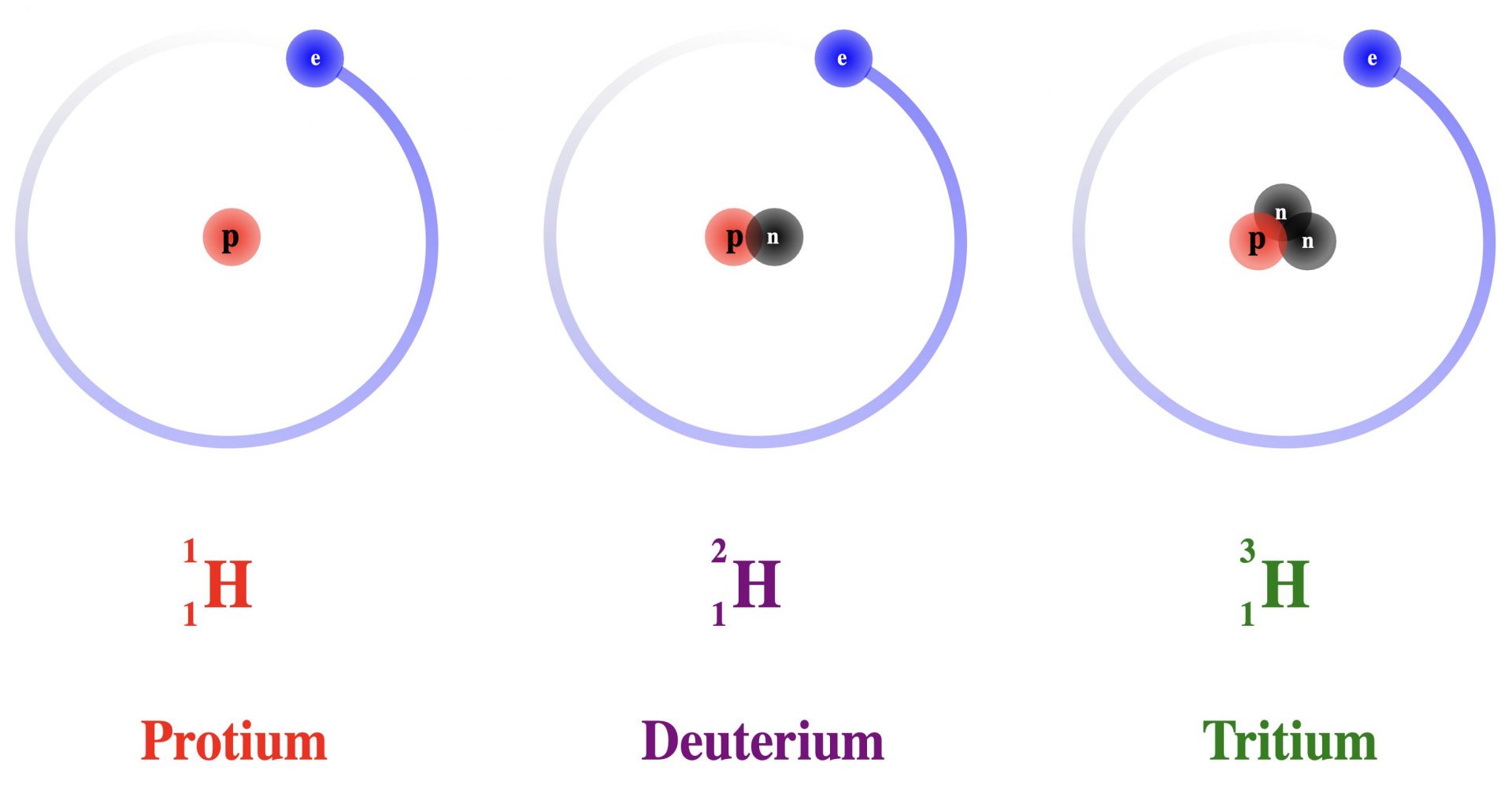
L’atome d’hydrogène possède deux isotopes. L’atome principal contient un proton et un nucléon.
Le premier isotope contient un proton et deux nucléons.
Enfin, le deuxième isotope de l’hydrogène contient un proton et trois nucléons.
Pour te permettre de mieux comprendre ce que l’on te raconte, on te propose de découvrir les schémas ci-dessous. Ils symbolisent les isotopes de l’hydrogène.
👉 Ainsi, on peut écrire un principe
Sont des isotopes s’ils ont:
- le même symbole ;
- le même nombre de protons ;
- le même nombre d’électrons ;
- la même charge positive dans le noyau ;
- la même charge négative dans le cortège électronique.
Les isotopes naturels et artificiels 🌿
Certains isotopes sont créés produits par la nature. D’autres ont été créés par les scientifiques pour des besoins énergétiques.
👉 Ainsi, le carbone possède plusieurs isotopes. Le carbone 12, carbone 13 et le carbone 14, qui a un rôle particulier (suspense, on te le révélera plus tard), sont tous issus de la nature. 🌳
👉 L’uranium est aussi un atome qui possède plusieurs isotopes. L’uranium 232, l’uranium 233 et l’uranium 236 ont été fabriqués par l’homme. Ils répondent à un besoin d’énergie et d’armement, en particulier pour la bombe nucléaire. ☢️

Les isotopes stables et les isotopes radioactifs ☢️
Certains isotopes sont stables et d’autres ne le sont pas. Ainsi, ceux qui ne sont pas stables sont considérés comme radioactifs. Ils vont se désintégrer au fur et à mesure et émettre des radiations durant la désintégration.
👉 Exemples :
Reprenons notre Carbone. Les isotopes 12 et 13 sont stables alors que le carbone 14, lui, ne l’est pas. C’est pourquoi il est utilisé par les scientifiques pour dater de l’eau ainsi que toute forme de vie sur terre. 😯
À lire aussi
N’hésite pas à lire notre article sur la radioactivité !
Si on reprend aussi notre Uranium, pour le coup, c’est très simple, tous ses isotopes naturels sont instables.

Pour info 💡
Les isotopes radioactifs peuvent aussi être appelés radionucléides ou radio-isotopes.
Besoin d’un prof particulier ? ✨
Nos profs sont là pour t’aider à progresser !
Les propriétés des isotopes ✨
Les isotopes possèdent le même cortège électronique. Par conséquent, ils ont les mêmes propriétés chimiques.
👉 Ils forment les mêmes ions stables ;
👉 Ils forment le même nombre de liaisons avec d’autres atomes ;
👉 Ils ont la même réactivité chimique, soit la même capacité à participer à des réactions chimiques.
Par contre, les isotopes n’ont pas la même masse. En effet, avec un nombre de nucléons différents, ils n’ont pas le même poids. Ainsi, ils n’ont pas les mêmes propriétés physiques. C’est-à-dire qu’ils n’ont pas la même température de fusion ou d’ébullition. 🔥

L’utilisation des isotopes dans la vie de tous les jours 🌍
Les isotopes ne sont pas seulement utiles en cours de physique-chimie. Ils le sont aussi dans la vie de tous les jours pour les scientifiques. Et c’est tant mieux, ça montre que ce qu’on t’enseigne à l’école a de l’importance. 😉
Ainsi, le Carbone 14 présenté un peu plus haut, est un isotope qui est très utilisé pour dater les éléments de la vie sur Terre comme l’eau, des pierres, des glaces, ou même encore des corps humains. Il permet de dire de quand date cette roche et ainsi, donner un âge aux éléments. 😯
Le carbone n’est pas le seul isotope à être précieux pour les scientifiques. L’iode 131 est aussi très utilisé pour traiter les cancers de la thyroïde, les cancers du foie, les douleurs de dos ou encore le cancer des os. 🦴
C’est la fin de ce chapitre sur les isotopes, on espère que tu as pu en apprendre plus sur eux. N’hésite pas à nous dire en commentaire si cet article a pu t’être utile ! Et si tu veux en savoir plus, n’hésite pas à prendre des cours de physique-chimie avec l’un de nos Sherpas ! 😉












