Lorsque tu dessines des espèces chimiques, tu veux découvrir la disposition de leurs électrons de valence. Mais dessiner toutes les couches d’électrons peut vite devenir compliqué. Pour cela, tu utiliseras des dessins appelés schémas de Lewis (eh oui, il y a des solutions pour tout).
Mouille-toi la nuque avec de l’H2O et viens découvrir les secrets des schémas de Lewis, let’s go! 🚀

Qu’est-ce qu’un schéma de Lewis ?
Avant de rentrer (ou de se perdre) dans le vif du sujet, tu dois sûrement te poser cette fameuse question : le schéma de Lewis, késako ? 🤔
Ne t’inquiète pas, tu es au bon endroit, ici on se dit tout, pas de cachoteries. 🤫
Le schéma de Lewis est un outil visuel (un dessin si tu préfères) utilisé en chimie pour représenter la structure électronique d’une molécule ou d’un ion.
Une molécule, un ion, c’est quoi ? 🧐
Une molécule est électriquement neutre (elle est constituée d’atomes liés entre eux). Un ion est électriquement chargé (il peut avoir une charge globale positive (cation) ou avoir une charge globale négative (anion).
Il utilise des symboles chimiques pour les atomes et des paires d’électrons pour montrer comment les électrons sont répartis dans la molécule, notamment pour indiquer les liaisons chimiques. C’est un moyen essentiel de comprendre et de prédire leur comportement chimique.
Les symboles atomiques
Les symboles atomiques sont des abréviations pour représenter les éléments chimiques. Chaque élément de la table périodique a son propre symbole atomique (basé sur son nom latin ou anglais). Ces symboles sont utilisés couramment en chimie pour identifier les éléments de manière simple. On te présente tout de suite quelques exemples :
-
H pour l’hydrogène,
-
O pour l’oxygène,
-
C pour le carbone,
-
Na pour le sodium,
-
Fe pour le fer,
-
He pour l’hélium.
Les symboles atomiques sont essentiels pour construire des schémas de Lewis et pour représenter les éléments dans les équations chimiques et les formules moléculaires.
Besoin d’un prof particulier ? ✨
Nos profs sont là pour t’aider à progresser !
Les électrons de valence
Les électrons de valence sont les électrons les plus externes d’un atome (pour faire simple, c’est la banlieue de l’atome). Ils occupent les niveaux d’énergie les plus éloignés du noyau atomique. 🫒
Ils sont responsables des interactions chimiques et de la formation de liaisons chimiques entre les atomes.
Les électrons de valence sont déterminés par la position de l’élément dans le tableau périodique. En général, le nombre d’électrons de valence correspond à la position de l’élément dans sa colonne du tableau périodique. Par exemple, les éléments du groupe 1 ont un électron de valence, ceux du groupe 2 en ont deux, et ainsi de suite. 🤓
Le savais-tu ?💡
La réactivité chimique d’un élément est en grande partie déterminée par le nombre d’électrons de valence.
Pour faire simple, les électrons de valence sont les électrons les plus importants dans la formation des liaisons chimiques. Ils jouent un rôle central dans la chimie, même si ce sont les électrons les plus externes.
Les liaisons chimiques
Les liaisons chimiques sont les forces qui maintiennent les atomes ensemble dans une molécule. Comme les Sherpas sont au top, on te présente les 3 principales liaisons chimiques :
-
Liaison ionique : elle se forme entre des atomes lorsqu’il y a transfert d’électrons d’un atome à un autre. Cela crée des ions chargés positivement (cation) et négativement (anion) qui sont attirés l’un par l’autre en raison de leurs charges opposées.
-
Liaison covalente : dans ce type de liaison, les atomes partagent des paires d’électrons pour atteindre une configuration électronique stable. Les liaisons covalentes se trouvent dans des composés comme l’eau (H2O). Les atomes d’hydrogène et d’oxygène partagent des électrons pour former des molécules.
-
Liaison hydrogène : il s’agit d’une liaison faible qui se forme lorsque l’hydrogène est lié à un élément très électronégatif, comme l’oxygène, le fluor ou l’azote.
Les liaisons chimiques sont essentielles pour former des composés chimiques stables et sont à la base de la chimie. 🧪

Ton premier cours particulier est offert ! 🎁
Nos profs sont passés par les meilleures écoles et universités.
Comment construire un schéma de Lewis ?
Passons au vif du sujet ! Imagine, tu sais déjà comment réaliser un schéma de Lewis. Bon, pas tout à fait, mais imagine quand même. Aujourd’hui, on t’explique comment faire !
La théorie
Le schéma de Lewis correspond à la représentation de la structure électronique externe de l’atome. Pour faire simple, on schématise l’atome de cette manière :
👍 Le noyau et les couches internes sont représentés par son symbole (par exemple l’hydrogène = H)
👍 Les électrons de la couche externe sont représentés par des points (.) s’ils sont célibataires (les pauvres 🥲) et s’ils forment un doublet non liant, cela est représenté par un tiret (-).
Le savais-tu ? 💡
Le nombre d’électrons célibataires est égal au nombre de liaisons que doit réaliser l’atome avec d’autres atomes (doublet liant).
Voici 2 exemples pour comparer :
| Atome | Hydrogène |
|---|---|
| Nombre d'électrons célibataires | 1 |
| Nombre de doublets non liants | 0 |
| Schéma de Lewis |  |
| Atome | Chlore |
|---|---|
| Nombre d'électrons célibataires | 1 |
| Nombre de doublets non liants | 3 |
| Schéma de Lewis |  |
Le savais-tu ? 💡
Parfois les atomes s’associent ! Les atomes mettent chacun en commun un électron célibataire lorsqu’ils s’associent dans une molécule par une liaison simple. Pour des liaisons multiples (double voire triples), ils mettent en commun deux ou trois électrons célibataires. 🧑🔬
Liaison simple :
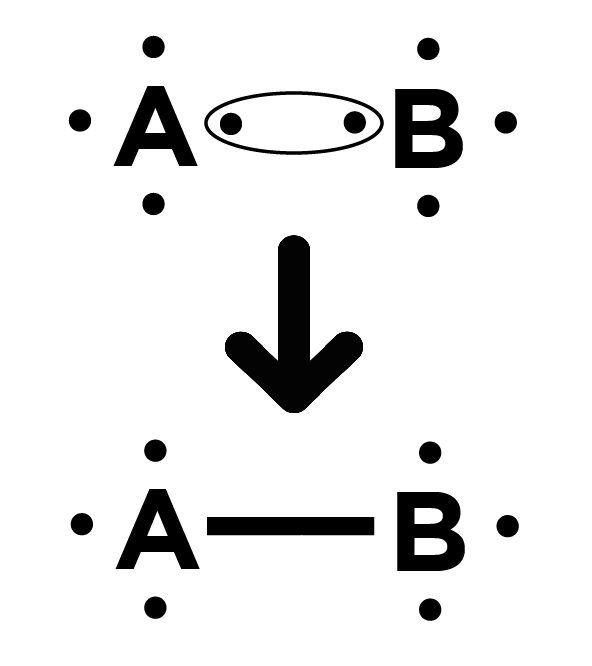
Liaison double :
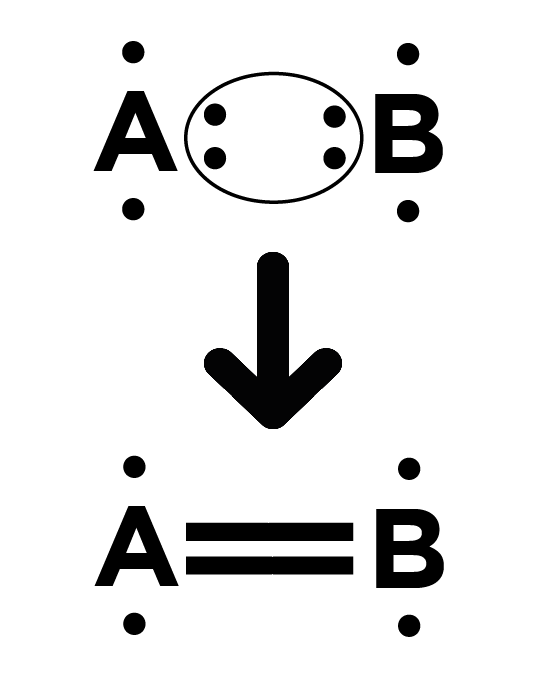
Quelques exemples
Après avoir vu la partie théorique (celle où on s’endort tout le temps) nous allons te réveiller avec 2 exemples concrets de schémas de Lewis. 🙂
Représentation du CO2 : ☁️
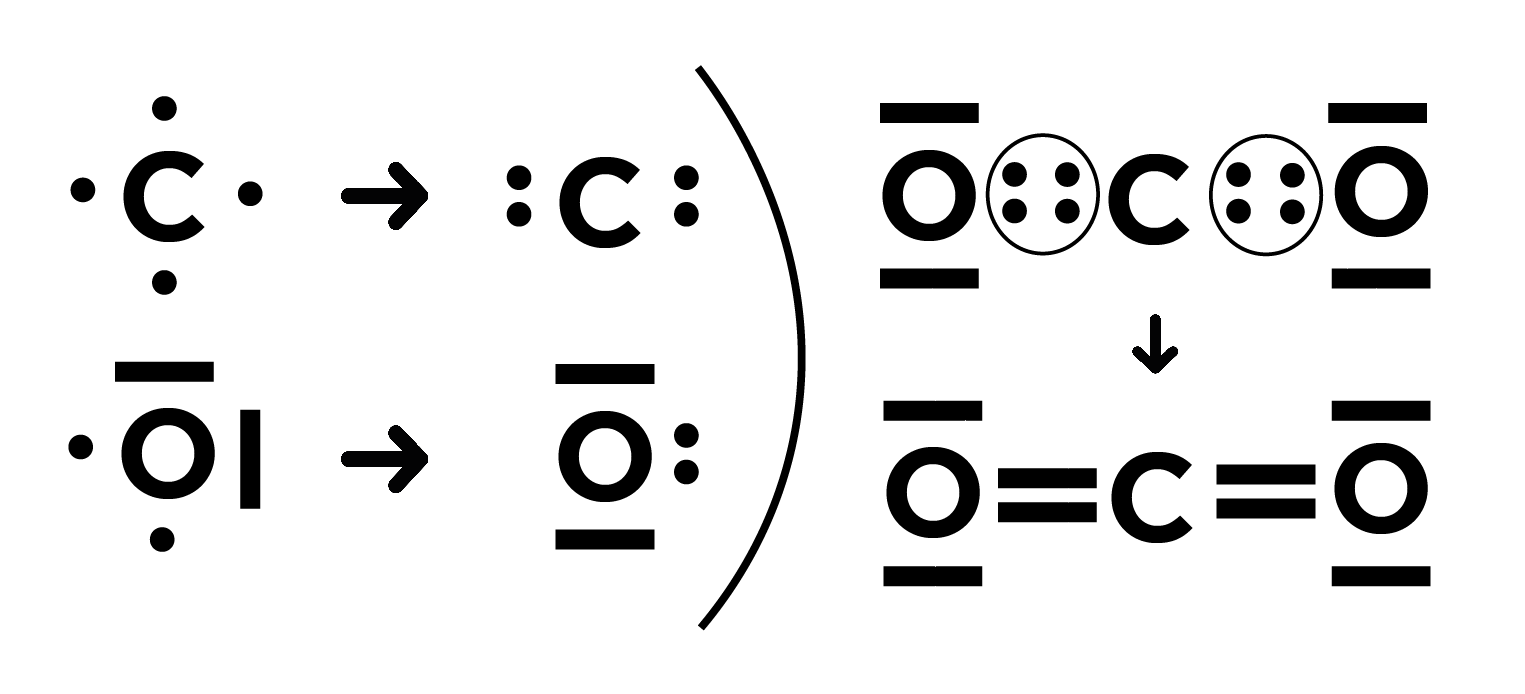
Représentation d’H2O : 💧
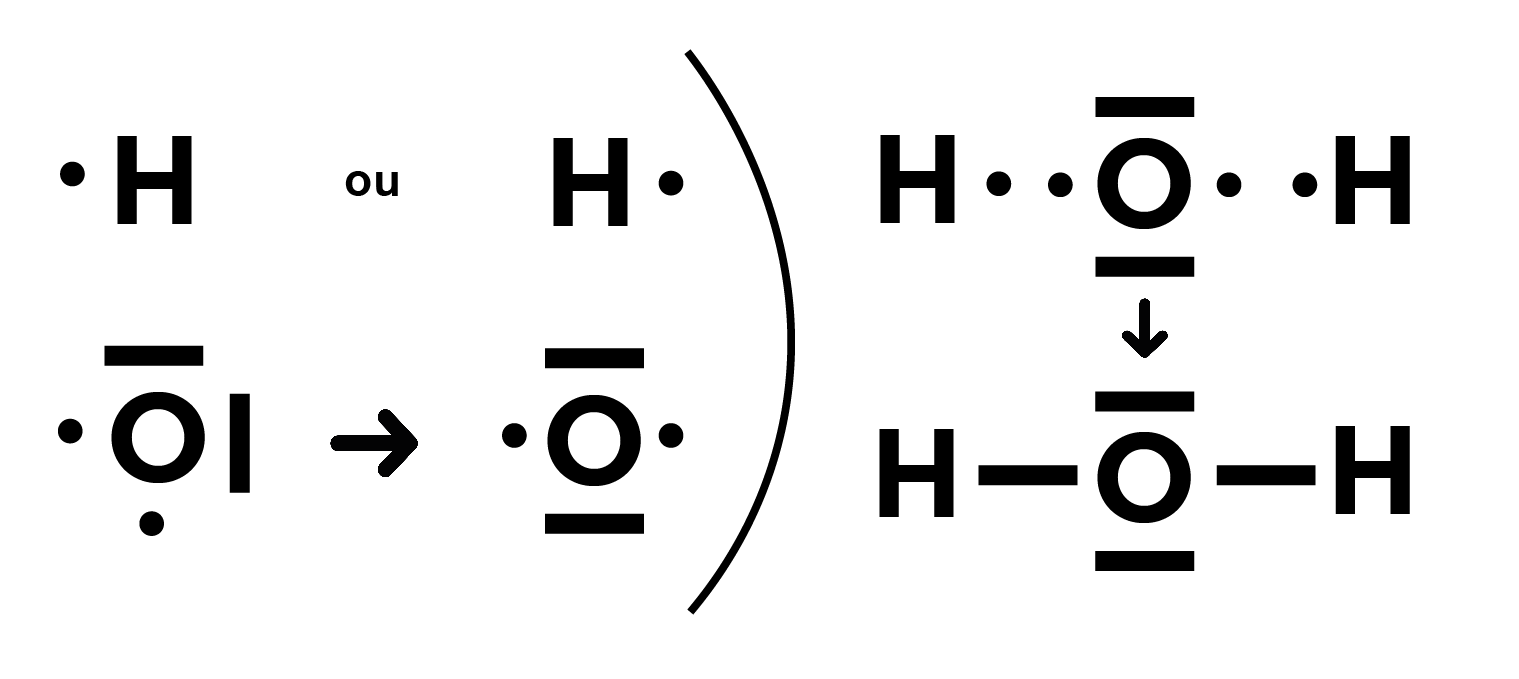
Besoin de cours particuliers ? ✨
4 points de plus sur ta moyenne avec nos profs Sherpas ! 📈
L’utilité d’un schéma de Lewis
Après tout, tu te demandes : à quoi sert le schéma de Lewis ? 🤔
Figure-toi qu’il a bien sûr beaucoup de points positifs (sinon on ne te le donnerait pas en cours…) On t’explique tout !
Ses aspects positifs
Le schéma de Lewis est un modèle simplifié (et très utile) en chimie pour représenter la structure électronique d’un atome ou même d’une molécule. Voici une petite liste de tous ses aspects positifs :
-
Simplicité : le schéma de Lewis est facile à comprendre et à utiliser. Il permet une représentation visuelle rapide et concise.
-
Clarté : En effet, il fournit une représentation claire de la façon dont les électrons sont répartis entre les atomes dans une molécule. Cela facilitera ta compréhension de la structure moléculaire.
-
Compréhension des réactions chimiques : le schéma de Lewis facilite la compréhension des mécanismes des réactions chimiques en montrant comment les électrons sont déplacés lors de ces réactions.
-
Utilisation dans l’enseignement : Ce schéma est couramment utilisé dans l’enseignement de la chimie. Cela te fait donc un bon outil à exploiter.
-
Analyse des structures électroniques : Il aide à comprendre la distribution des électrons dans un atome ou dans une molécule. Cela te sera essentiel pour prédire les propriétés chimiques par exemple.
Et voila, maintenant tu en sais un peu plus sur la fameuse notion du schéma de Lewis. Si tu veux en savoir plus, nos professeurs de physique-chimie sont là pour toi !
Les Sherpas espèrent t’avoir donné un coup de pouce. 👍

À la prochaine ! 👋













